07-б. Частицы веществ
§ 07-б. Частицы веществ
В предыдущем параграфе мы назвали три основных положения МКТ и отметили, что они подтверждены экспериментами. Большинство из них очень сложны (как в проведении, так и в понимании результатов), поэтому мы рассмотрим лишь простейшие опыты-иллюстрации.
Существование промежутков между частицами. В одну мензурку нальём 100 мл воды, а в другую — 100 мл подкрашенного спирта. Перельём жидкости из этих мензурок в третью (см. рисунок). Удивительно, но объём смеси получится не 200 мл, а меньше: 190 мл. Однако при этом масса смеси в точности равна сумме масс воды и спирта. Почему же так происходит?
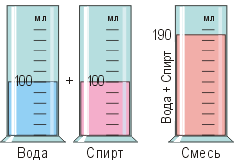
Установлено, что вода и спирт состоят из частиц, называемых молекулами. Они настолько малы, что не видны ни в лупу, ни в микроскоп. Тем не менее известно, что молекулы спирта в 2–3 раза крупнее молекул воды, поэтому межмолекулярные промежутки в спирте крупнее, чем в воде. При смешивании молекулы воды размещаются в промежутках между молекулами спирта. Заполнение этих межмолекулярных промежутков и способствует уменьшению объёма смеси, не влияя на сумму масс частиц.
Малость размеров частиц веществ. Возьмём несколько пробирок. В первую нальём воды и бросим несколько крупинок краски. Перемешав воду, мы увидим, что крупинки растворились, а вода приобрела равномерную насыщенную окраску. Отольём часть раствора во вторую пробирку и дольём воды. Окраска раствора станет светлее, но после размешивания опять будет равномерной. Опыт можно повторить много раз, но при любом разбавлении окраска раствора остаётся равномерной. Почему так происходит?

Подобно воде и спирту, краска состоит из мельчайших частиц, которые нельзя увидеть «поодиночке». Если бы они были крупнее, то вместо равномерной окраски мы увидели бы прозрачную воду с плавающими в ней частичками краски.
Виды частиц веществ. Наукой установлено, что вода, сахар, спирт и почти все газы состоят из разных частиц, которые относят к молекулам. Соль, сода, уксус тоже состоят из разных частиц, но их относят к ионам. Алмаз, фосфор, сера, газы гелий и неон состоят из частиц, которые относят к атомам. Например, в солёной воде содержатся следующие частицы: молекулы воды, ионы натрия и хлора. А в стальном предмете, например ноже или ложке, есть ионы железа, атомы углерода и другие частицы примесей, которые добавляют к железу при изготовлении сталей и сплавов различных марок.
Разобраться с видами и названиями этих частиц вы сможете лишь тогда, когда изучите курсы физики и химии 8 класса. А пока мы будем говорить просто «частицы вещества», подразумевая под ними молекулы, ионы и атомы. Пожалуйста, наберитесь терпения и постепенно привыкайте к этим новым для вас терминам.
Неизменность частиц веществ. Как вы знаете, вещества в зависимости от температуры и давления могут быть твёрдыми, жидкими, газообразными. Возникает вопрос: одинаковы ли частицы одного и того же вещества, но в различных состояниях?
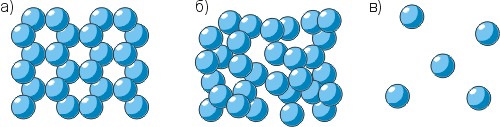
Физическими и химическими опытами установлено, что частицы вещества остаются прежними при изменении его состояния (то есть сохраняется их вид, размеры и масса). Например, расплавленный воск или стеарин застывает и становится непрозрачным; водяной пар в мороз превращается в кристаллики инея и так далее. При этом сами частицы стеарина, воды и вообще частицы всех веществ остаются прежними, однако меняется расположение частиц и расстояния между ними.
На рисунке показано расположение молекул воды в твёрдом (а), жидком (б) и газообразном (в) состояниях. Обратите внимание: сами молекулы одинаковы, однако их расположение и расстояния между ними различны.